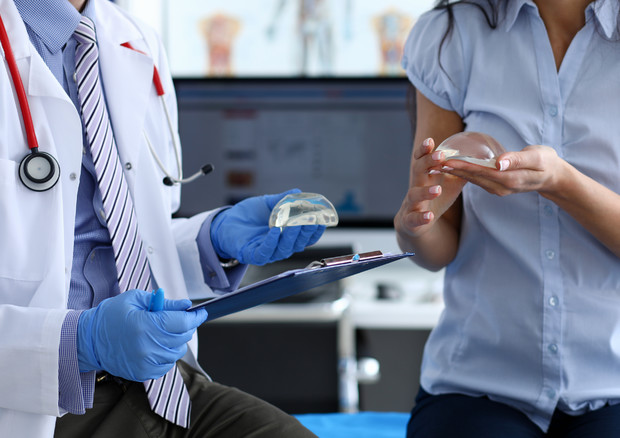
Al via il regolamento che rende obbligatorio il primo 'Passaporto' di sicurezza UE sulle protesi per il seno. I dispositivi mammari diventano interamente tracciabili e più sicuri grazie ad un 'super numero seriale' (UDI, Unique Device Identification), valido per tutti i mercati europei, che accompagnerà ogni singolo prodotto che circola nel territorio europeo. L'UDI sarà univoco per ciascun singolo prodotto e ne ottimizzerà il tracciamento attraverso l'intera filiera di produzione e di impiego (dal produttore, al distributore/rivenditore/importatore e fino alle cliniche/chirurgo) in nome di una totale tracciabilità e monitoraggio dei dispositivi medici.
Convalidate anche le 'istruzioni elettroniche' per l'uso, nelle lingue accettate da ciascun Paese UE.
Migliori, inoltre, i dossier di sicurezza obbligatori per i produttori: conterranno più dati clinici di follow-up e, ulteriori studi sui prodotti.
Le novità sono contenute nel Medical Device Regulation (EU) 2017/745 (MDR) dell'Unione Europea che - operativo da oggi, 26 maggio, su tutto il territorio europeo - fissa per i dispositivi medici nuovi requisiti, introducendo prospettive di valutazione e tracciabilità valide in tutto il territorio europeo.
In attesa che parta anche la più grande banca dati a marchio UE dei dispositivi medici (EUDAMED) usati in tutti i paesi membri, ad oggi ancora non operativa. A questa ultima infatti dovranno afferire molte delle nuove informazioni che il Regolamento definisce.
Nel nuovo regolamento europeo sui dispositivi medici operativo a partire da oggi la parola 'safety' si ripete per ben 290 volte, nella precedente direttiva invece era citata solo 40 volte. Il nuovo testo è quattro volte più lungo del precedente.
Mariangela Dal Pra, Managing Director Italia Polytech Health & Aesthetics spiega che "In Polytech le voci del regolamento sono ampiamente anticipate da almeno venti anni. Il nostro Implant Passport per la paziente permette la completa tracciabilità dei dispositivi del brand. Plaudiamo al nuovo regolamento, perché organizzare una vera tracciabilità ed incrementare la sicurezza dei prodotti e della filiera corrispondono ad un importante passo avanti nella tutela delle pazienti". (ANSA).