W. L. Gore & Associates, Inc. (Gore) ha annunciato oggi il primo impianto in un paziente europeo dell'endoprotesi AAA comoda GORE® EXCLUDER® con sistema ACTIVE CONTROL. Questo dispositivo per la riparazione endovascolare di prossima generazione (EVAR) è indicato per il trattamento della più ampia gamma di aneurismi aortici addominali (EVAR) in pazienti con anatomie complesse. I medici ora hanno una soluzione EVAR adatta per il trattamento di pazienti che prima venivano esclusi a causa di colli aortici prossimali complessi.
questo comunicato stampa include contenuti multimediali. Visualizzare l’intero comunicato qui: https://www.businesswire.com/news/home/20180918006063/it/
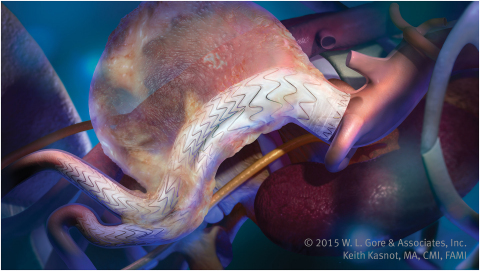
GORE® EXCLUDER® Conformable AAA Endoprosthesis with ACTIVE CONTROL System (Graphic: Business Wire)
L'endoprotesi AAA conformabile GORE EXCLUDER con sistema ACTIVE CONTROL è un marchio approvato per pazienti con angolature aortiche del collo fino a 90 gradi con un minimo di collo aortico di 15 mm o in pazienti con angolature aortiche del collo fino a 60 gradi e una lunghezza aortica minima di 10 mm.
La procedura, che è riuscita, ha avuto luogo l'11 settembre al Catharina Hospital di Eindhoven, Paesi Bassi, ed è stata eseguita da Marc van Sambeek, MD. Il paziente era anche il primo a iscriversi in un registro avviato da uno sperimentatore post-commercializzazione europeo, conosciuto con il nome EXCeL (EXcluder Conformable real Life), di cui il Prof. van Sambeek è il princiale sperimentatore.
“Prima di questo dispositivo, l'EVAR era riservato ai pazienti con un'aorta della misura e forma standard”, ha detto il Prof. van Sambeek. “La comodità del dispositivo conformabile del nuovo GORE EXCLUDER in combinazione con il controllo dell'angolazione del nuovo sistema di impianto ci permetterà di offrire un'alternativa meno invasiva, a basso rischio, alla chirurgia aperta per più pazienti AAA rispetto a prima. Il registro EXCeL monitorerà l'efficacia nel mondo reale e la sicurezza del dispositivo; sarò lieto di accogliere altri pazienti con anatomie complesse, con anatomie aortiche molto angolate, e scoprire il valore a lungo termine di questo dispositivo.”
Il registro EXCeL iscriverà 150 pazienti provenienti da fino 11 sedi europee. I dati del registro valuteranno la sicurezza e il successo del trattamento del dispositivo conformabile AAA GORE EXCLUDER per il trattamento infrarenale AAA in un'ampia gamma di conformazioni anatomiche. Il dispositivo è anche valutato per uno studio statunitense fondamentale nel quale il primo paziente è stato registrato il 19 dicembre 2017.
Il dispositivo conformabile AAA EXCLUDER sfrutta la prestazione comprovata dell'endoprotesi AAA GORE® EXCLUDER®, che rappresenta oltre 20 anni di esperienza a livello mondiale e più di 300.000 pazienti trattati*, questi dati sono ineguagliati dagli innesti AAA attualmente disponibili. Il nuovo dispositivo sfrutta il design dell'arto del dispositivo GORE EXCLUDER che ha avuto prestazioni cliniche eccezionali, come comprovato dallo 0.5% di occlusione degli arti nel follow up a 3 anni.** Gli arti, una combinazione unica di materiale di innesto ePTFE di proprietà e uno stent interamente supportato, innestato al nitinolo sono ideati per prevenire l'attorcigliamento e le occlusioni.
Il nuovo dispositivo introduce il sistema ACTIVE CONTROL nel trattamento AAA. Questo nuovo sistema introduce un innesto di stent e di posizionamento del dispositivo migliorato e un controllo d'angolazione opzionale. Per migliorare il posizionamento, il dispositivo è usato in modo parzialmente limitato e il chirurgo ha la possibilità di vincolare la parte prossimale del dispositivo per aiutare a raggiungere il posizionamento ottimale. Durante l'uso, il medico può usare il controllo dell'angolazione opzionale per controllare l'angolaizone del dispositivo per posizionare il dispositivo e raggiungere un posizionamento ortogonale per il lumen del flusso sanguigno verso l'aorta e per massimizzare la conformabilità del dispositivo e la tenuta.
“Con questo primo impianto in Europa, continuiamo il nostro impegno a offrire le capacità di trattamento più ampie e tecnicamente più avanzate ai medici e ai loro pazienti,” ha detto Eric Zacharias, Vascular Business Leader. “Ci impegnamo a sviluppare una tecnologia che permette ai medici di trattare meglio le anatomie aortiche complesse. Collaborando con i medici, abbiamo sviluppato il nostro dispositivo, leader di mercato, GORE EXCLUDER, per permettere a un maggior numero di pazienti di essere trattati con EVAR.”
Il dispositivo AAA conformabile GORE EXCLUDER fa parte della crescente famiglia di prodotti endovascolari che condividono un unico obiettivo: la cura efficace dei malfunzionamenti dell'aorta, grazie al prezioso sostegno dei team di supporto clinico e dell'offerta formativa di Gore.† Il portafoglio completo di prodotti aortici include anche l'endoprotesi toracica conformabile GORE® TAG® Conformable con sistema ACTIVE CONTROL per il trattamento degli aneurismi, delle transezioni e delle dissezioni toraciche di tipo B; l'endoprotesi per la branca iliaca GORE® EXCLUDER® , l'unico dispositivo già pronto per l'uso approvato dalla FDA e indicato per il trattamento endovascolare degli aneurismi comuni dell'arteria iliaca o degli aneurismi aorto-iliaci e l'endoprotesiGORE® VIABAHN® VBX Balloon Expandable per il trattamento delle lesioni nuove e restenotiche, incluse le lesioni della biforcazione aortica.
* In base al numero di Trunk-Ipsilateral Legs distribuiti.
** GREAT. n = 3,273. Per calcolare i tassi generali, dell'evento dalla procedura fino alla fine del periodo dello studio, sono state incluse tutte le persone che potrebbero aver avuto eventi, indipendentemente dalla durata del follow-up. Per i dati del risultato, GREAT raccoglie solo gli eventi avverti seri riportati al sito.
† Per le indicazioni complete e altre importanti informazioni sulla sicurezza dei prodotti commerciali Gore a cui si fa riferimento, si rimanda alleIstruzioni per l'uso (IFU) applicabili.
DIVISIONE PRODOTTI MEDICI
Gore progetta dispositivi per il trattamento di una vasta gamma di patologie cardiovascolari e di altro tipo. Con oltre 40 milioni di dispositivi medicali impiantati in più di 40 anni, Gore sfrutta la propria esperienza nel miglioramento dei risultati per i pazienti grazie alla ricerca, alla formazione e a iniziative di alto livello. La performance e la facilità di utilizzo dei prodotti, accompagnate dalla qualità del servizio, permettono a personale sanitario, ospedali e società di assicurazione di risparmiare sui costi in maniera sostenibile. Lavorando a stretto contatto con il personale sanitario, Gore migliora la vita dei pazienti. www.goremedical.comwww.goremedical.com
ABOUT W. L. GORE & ASSOCIATES
W. L. Gore & Associates è una società globale nel settore della scienza dei materiali impegnata nella trasformazione delle industrie e nel miglioramento della vita. Fondata nel 1958, Gore è famosa per la capacità di risolvere complessi problemi tecnici negli ambienti più difficili, dalla rivoluzione nel settore dei tessuti con i prodotti GORE-TEX ® alla creazione di dispositivi medicali che migliorano e salvano la vita dei pazienti, passando per nuovi livelli di performance nei segmenti aerospaziale, farmaceutico, dell'elettronica mobile e altri ancora. La società è famosa anche per la sua solida cultura orientata al lavoro di squadra e per il riconoscimento internazionale da parte del Great Place to Work® Institute. Dalla sede di Newark, Del., Gore collabora con 9.500 associati e genera un fatturato annuo di 3,5 miliardi di dollari USA. www.gore.com
I prodotti elencati potrebbero non essere disponibili su tutti i
mercati
GORE®, GORE-TEX®,
ACTIVE CONTROL, EXCLUDER®, TAG®,
VBX, and VIABAHN® sono marchi commerciali di W. L.
Gore & Associates. AX0416-EN1 SEPTEMBER 2018
Il testo originale del presente annuncio, redatto nella lingua di partenza, è la versione ufficiale che fa fede. Le traduzioni sono offerte unicamente per comodità del lettore e devono rinviare al testo in lingua originale, che è l'unico giuridicamente valido.
Vedi la versione originale su businesswire.com: https://www.businesswire.com/news/home/20180918006063/it/
Ufficio stampa:
Bliss
Integrated Communication per Gore Medical
Liz DeForest, 212-584-5477
Liz@blissintegrated.com
Permalink: http://www.businesswire.com/news/home/20180918006063/it








